Avaliando Propriedades de um Sistema
1) Introdução:
Para avaliar um sistema térmico, já vimos nas aulas anteriores que um sistema possui propriedades, que por sua vez determinam seu estado. Muitas vezes essas propriedades podem ser dependentes ou independentes. O fato de conhecer propriedades independentes em um sistema, podemos entrar nos conceitos de princípio dos estados equivalentes e sistemas compreensíveis simples.
2) Definindo o Estado:
Primeiramente, cabe explicar o que é o estado de um sistema. O estado de um sistema é quando conhecemos os valores das propriedades ( pressão, temperatura, volume, etc) do sistema.
Que nem citado na introdução dessa aula, nem todas propriedades são independentes, porém com as propriedades independentes, podemos determinar outras propriedades de um sistema. Ou seja, determinamos quais propriedades serão independentes e calculamos as propriedades que depender das determinadas anteriormente.
Como exemplo imagine uma função z =f(x,y), na teoria de funções chamamos de f(x,y) ou z de variável dependente e x, y de variáveis independentes. O mesmo vale para as propriedades de um sistema, colocando por exemplo a temperatura (T) e o volume específico (v) como propriedades independentes, podemos calcular a pressão p = p(T,v) ou u = u(T,v).
- Princípio dos estados equivalentes: É o número suficiente de propriedades intensivas independentes para determinar outras propriedades de um sistema. Caso o sistema for uma substância pura, simples e homogênea, precisamos somente de 2 propriedades intensivas independentes para tal determinação.
- Sistema compreensível simples: Onde os efeitos do movimento, viscosidade, tensão superficial, capilaridade, e forças
externas estão ausentes.
3) Relação P - V - T:
3.1) Superfície P-V-T:
Considerando um sistema compreensível simples, no qual vamos utilizar 3 propriedades básicas de um sistema. No qual duas delas, podem determinar a outra propriedade. Essas 3 propriedades são : Pressão, Volume específico e Temperatura.
Lembre-se que estamos falando de uma substância simples, homogênea e em equilíbrio.
Podemos ter as seguintes condições de uma substância:
- Monofásica – quando a substância está apenas em um estado físico – o estado pode ser determinado por 2 propriedades independentes.
- Bifásico – quando duas fases coexistem em equilíbrio ( Sólido – líquido, líquido – vapor, sólido – vapor). Um região bifásica pode existir quando a substância está em um processo de transição de fase – Vaporização, sublimação e fusão. Nessa região não da para determinar o estado de um sistema apenas duas propriedades intensivas, uma vez que não tem como seleciona-las como independentes, uma vez que mudado o valor de algumas das três propriedade, mudará o resto dos outros valores, impossibilitando a determinação do estado.
- Trifásico – É quando coexistem as três fases de uma substância, conhecida então como ponto triplo.
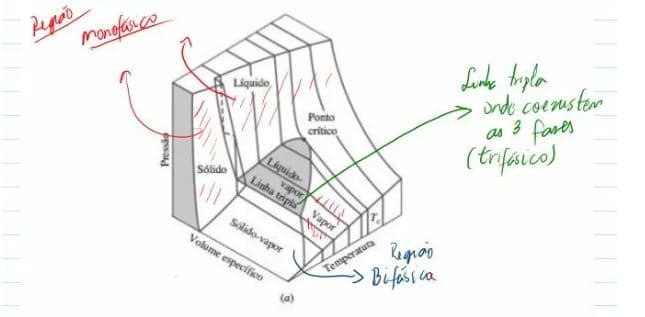
Ponto crítico: máxima temperatura onde as fases líquido e vapor podem coexistir (ponto de p, T e v críticos)
Estado de Saturação: À temperatura e pressão de saturação o líquido existente é chamado de líquido saturado. Se a temperatura do líquido é menor do que a temperatura de saturação, temos líquido sub-resfriado ou líquido comprimido (a pressão é maior do que àquela de saturação para a dada temperatura).
3.2) Projeções da Superfície P-V-T:
É a representação da relação de fases P-V-T em um plano, como por exemplo as duas figuras abaixo:
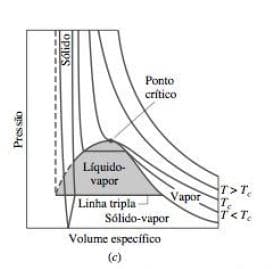
Observe que as regiões bifásicas se reduziram à linhas agora, e podemos ter algumas análises interessantes, como por exemplo a temperatura e a pressão de saturação.
Temperatura de saturação: Refere-se a temperatura em que a substância