Calorimetria
1) Caloria (cal):
Unidade de calor, que embora não pertença ao S.I é muito usada atualmente.
Definição:
Foi definido que 1 caloria é a quantidade de calor para elevar 1ºC de 1º grama de água. Porém, por haver algumas variações, foi determinado essa definição quando a água se encontra na temperatura de 13,5ºC e 14,5ºC.
2) Joule (J):
Depois que foi estabelecido que é uma forma de energia, começou-se utilizar a unidade Joule.
A relação de Joule cm calorias é dado por: 1J = 4,186 cal.
O interessante é que agora a definição de calor não depende mais da água e da sua temperatura.
3) Capacidade térmica:
Quando um corpo recebe calor, pode acontecer duas coisas: A variação de temperatura e Mudança do estado de agregação da matéria.
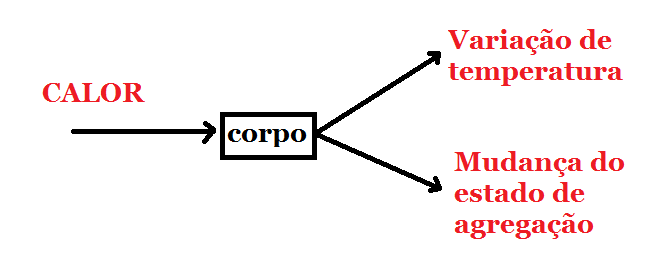
Nesse capítulo, vamos considerar que no corpo só há variação de temperatura. Se um corpo recebe ou perde uma quantidade de calor Q, a variação de temperatura é proporcional ao valor de calor recebido ou perdido:
Q = C.Δθ
Sendo que:
- Q = Quantidade de calor recebida ou perdido pelo corpo.
- C = Capacidade térmica do corpo.
- m = massa do corpo.
º Unidades:
Isolando capacidade térmica da equação (C) -> C = Δθ/Q, agora basta substituir as variáveis pelas suas respectivas.
- [C] = [J]/ [K]
- [C] = [cal]/[ºC]
- [C] = [cal]/ºF
- [C] = [kcal]/ºC
- [C] = [KJ]/K
SIM! SÃO MUITAS FORMAS DIFERENTES! Mas em dúvida use as unidades de 1.(que é do S.I).
4) Calor específico:
Experimentos realizados mostram que em um corpo homogêneo, a capacidade térmica é proporcional à massa do corpo, portanto:
C = c.m
c -> constante de proporcionalidade – depende do material.
m -> Massa do corpo
Q = m.c.Δθ
Para lembrarmos dessa equação chamamos de: “QUE MACETE” > Q -> CALOR, C -> CONSTANTE, TE -> TEMPERATURA!
Unidade do calor específico:
[c] = cal/(g.ºC) ou [c] = J/(Kg.K).
Interpretação das unidades:
“A cada X calorias que um corpo absorve, há um aumento de temperatura de Y graus em Z gramas.”
Ficou confuso? Vamos para um exemplo prático: Se c = 0,2 cal/g.ºC então quer dizer que o corpo precisa absorver 0,2 calorias para aumentar 1 ºC de 1 grama da sua massa.
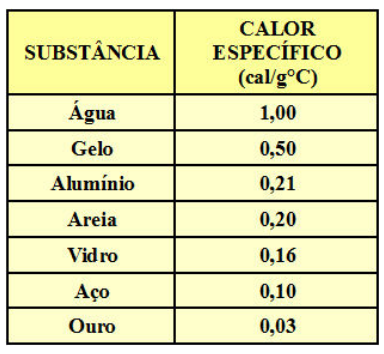
5) Tabela de valores de calor específico:
Agora que eu passei a interpretação das unidades do calor específico, é interessante vocês analisarem a tabela de calores específicos de diversas substâncias.